王晓东实验室发现雌激素诱导细胞凋亡的分子学机制及其生理学意义
► 图片来自pixabay
● ● ●
通过近几十年的科学研究,我们现在知道细胞凋亡是受一系列基因控制的程序性的细胞死亡方式,在机体正常的生长,发育以及某些生理或病理条件下被激活。其中,已知的例子有:从蝌蚪到蛙的变态发育;昆虫的蜕变; 高等哺乳动物指间蹼的消失,如人体胚胎发育中,胚胎长到第5周时出现扁盘状的肢体萌芽、手指和脚趾之间蹼的消失;眼睛玻璃体和晶状体的细胞死亡,是眼睛对光通透性重要的一步。
即使在成熟的个体中,细胞凋亡也是必不可少的。比如,细胞数目和组织大小的控制(平均每个成年人每天损失50-700亿个细胞);免疫细胞对有潜在危险细胞的清除;赋予中枢神经系统可塑性。细胞凋亡的特征是,细胞起泡,皱缩,核碎裂,染色质浓缩,染色体dna片段化和全局mrna衰变。
最终细胞的内容物被细胞膜包裹成凋亡小体,凋亡小体被附近的巨噬细胞所吞噬,因此细胞凋亡不会引起免疫反应。机体无时无刻不进行着细胞凋亡,如果该死亡通路被阻断,则机体会发生病变,某些肿瘤的产生就是由于正常凋亡的细胞无法死亡而过度增殖的结果。
根据目前的研究结果,细胞凋亡可分为两条通路:
其一,细胞外凋亡通路。该通路是由细胞外tnfα-tnfr (tnfα receptor)等诱导凋亡的细胞介素所介导。如tnfα结合细胞膜上的受体tnfα receptor,从而招募rip1或tradd,进一步结合fadd和caspase8形成complex ii (disc, death-inducing signaling complex),使caspase8活化,进而活化其下游底物caspase3,caspase3的活化标志着细胞终以凋亡的形式死亡。
其二,细胞内凋亡通路(也称线粒体凋亡通路)。该通路是受一类含有bh(bcl-2 homology)结构域的蛋白所控制。bax和bak的寡聚化作用与线粒体的外模使线粒体的外模形成孔道,使细胞色素c释放到细胞浆中结合apaf-1并进一步招募caspase9,在atp/datp存在的条件形成凋亡复合物(apoptosome)使caspase9自切割活化,进一步激活其下游底物caspase3。在正常细胞内bax和bak的寡聚化被抗凋亡蛋白bcl-2, bcl-xl和mcl-1所抑制。
但内源凋亡通路有一个重要的问题没有回答,之前研究内源凋亡通路通常用癌症治疗的化学药物或者用uv照射的方法激活该通路,那么在体内存在诱导内源凋亡通路体的诱导剂是什么?如何激活凋亡通路?
►细胞凋亡的形态
王晓东实验室过去几十年一直在研究细胞凋亡和细胞坏死的生物化学通路。2019年8月13日,晓东实验室在《molecular cell》杂志在线发表了题为"estrogen-related hormones induce apoptosis by stabilizing schlafen-12 protein turnover"的长文,文章系统性地揭示了雌激素(e2)作为体内诱导内源凋亡通路的分子学机制及其生理学意义。
作者在研究卵巢衰老课题的过程中,偶然发现雌激素在2.5-10 μm(远高于血液浓度)可以诱导hela细胞死亡,根据细胞死亡的形态可以判断为细胞凋亡。通过敲除外源细胞凋亡通路和内源凋亡通路的关键蛋白caspase8和caspase9得出,敲除caspsae9可以完全阻断雌激素导致的caspase3的活化,证明雌激素诱导的细胞死亡通过内源凋亡通路。但奇怪的是,即使阻断内源凋亡通路也无法阻断雌激素诱导的细胞死亡,但可以改变细胞死亡的形态。因此可以推测,在线粒体凋亡通路的上游存在控制该凋亡通路的关键步骤。
接着作者通过化合物和crispr全基因的筛选得出pde3a (phosphodiesterase 3)和slfn12(schlafen family member 12)是该凋亡通路的关键蛋白,敲除任何一个基因可以完全阻断雌激素诱导的细胞凋亡。随后证实雌激素结合pde3a的酶活性结构域 (pde3a是雌激素在机体内的第四个受体,作者后续发现其它一些化合物也可以结合pde3a并激活该细胞凋亡通路,因此可以推测pde3a的水解camp和gamp酶的活性结构域像是一个很大的“口袋”, 可以感知不同的化合物而激活该凋亡通路),推测结合雌激素后pde3a的构象会发生改变,结合并稳定其下游底物slfn12(在正常条件下slfn12通过泛素通路被降解,在细胞内的水平很低,几乎检测不到)。
作者后续通过免疫共沉淀结合质谱技术,发现e2-pde3a-slfn12复合物的下游底物是核糖体,后续的实验证实slfn12结合在核糖体的rna上。e2-pde3a-slfn12结合核糖体复合物后阻断了蛋白质的翻译,同时也阻断了srp(signal recognition particle)与核糖体的结合,由于核糖体需要srp的协助才能转运到内质网的外模进一步合成细胞内的膜分泌蛋白,e2-pde3a-slfn12的结合使核糖体无法合成细胞内的膜蛋白。
导致bcl-2和mcl-1的蛋白水平降低使其无法抑制bax和bak的活性,bax和bak寡聚化作用与线粒体的外膜形成孔道使细胞色素c释放到细胞质中激活caspase9,并进一步激活caspase3,最终细胞以凋亡的形式死亡。由于e2-pde3a-slfn12复合物作用与核糖体抑制膜蛋白质的反应,所以即使阻断线粒体凋亡通路也无法抑制细胞死亡。该论文第一次完整地把内源凋亡诱导剂雌激素和生物化学通路解析了出来。
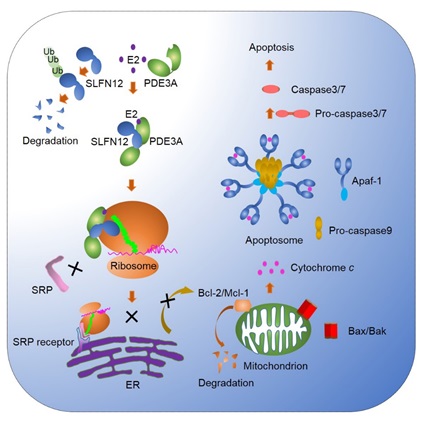
►雌激素(e2)诱导细胞凋亡的模型
随后的问题是雌激素诱导细胞凋亡的生理学意义是什么? 作者后续与abcam公司合作开发出slfn12的单克隆抗体,由于slfn12只有在雌激素诱导的条件下才能被检测到,因此可以作为雌激素诱导细胞凋亡通路的特异标志物。根据之前的研究结论,体内只有在一个部位的雌激素可以达到诱导细胞凋亡的浓度,那就是怀孕期的胎盘组织。胎盘组织雌激素的局部浓度最高可以达到12 μm,且根据以前的文献报道,胎盘的发育以及随后在侵染子宫内膜上皮的过程中需要激活细胞凋亡通路,因此提示在胎盘的生长和发育过程中,可能该细胞凋亡通路被活化。
为了检测在人胎盘组织内雌激素诱导的凋亡是否被激活,晓东实验室和广州妇女儿童医疗中心合作, 由广州妇女儿童医疗中心提供人自然流产的胚胎样本,通过免疫组化实验证明,在流产的胎盘组织的多核滋养层细胞内检测到很强的slfn12信号,且slfn12信号与活化的caspase3信号存在共定位。揭示雌激素诱导的细胞凋亡在人胎盘侵染和发育过程中起重要的作用。该通路是否影响人胚胎的流产还需进一步的研究。
论文链接:
注:本文转载自北京生命科学研究所。








